01、導(dǎo)讀
鋰空氣電池是一種以金屬鋰為負(fù)極,以空氣中的氧氣為正極的鋰離子電池,放電時,一般在正極生成Li2O2,充電時Li2O2分解。與鋰離子電池相比,鋰空電池的能量密度達(dá)到3400 Wh/kg,是下一代鋰離子電池的有力競爭者。但是,正極生成的Li2O2導(dǎo)電性差、充電時不能完全分解,導(dǎo)致現(xiàn)有鋰空電池存在能量效率低、倍率性能差、循環(huán)壽命短的問題。除了Li2O2,鋰空電池還會生成LiOH、LiO2和Li2O等產(chǎn)物。基于LiOH的電池在室溫下表現(xiàn)出良好的能量效率和循環(huán)倍率性能,還可以在高濕度環(huán)境下運(yùn)行,比Li2O2更耐CO2,實(shí)用性更強(qiáng),因而受到研究者的廣泛關(guān)注。
鋰空電池放電過程中LiOH的形成機(jī)理非常復(fù)雜,還有許多關(guān)鍵問題存在爭議,闡明其形成過程對于鋰空電池的實(shí)用化具有重要意義。
02、成果背景
近期,Angewandte Chemie International Edition上發(fā)表了一篇題為Unravelling the Complex LiOH-Based Cathode Chemistry in Lithium–Oxygen Batteries的文章。為全面了解鋰空電池中LiOH正極的形成機(jī)理,該工作制備了Ru/碳納米管(Ru/CNT)正極催化劑和一系列含水率可控的電解液,組裝成鋰空電池,采用多種表征手段和從頭計算方法,對鋰空電池中LiOH的形成機(jī)理進(jìn)行了研究,發(fā)現(xiàn)在Ru/CNT的催化下,LiOH是通過四電子還原反應(yīng)形成的。隨著酸性質(zhì)子的不斷累積,與OH*結(jié)合,還會形成質(zhì)子耦合水,導(dǎo)致一個新的高電壓平臺的形成,從頭計算結(jié)果和密度泛函理論均支持了上述結(jié)論。這一成果為LiOH基鋰空電池的實(shí)用化鋪平了道路,為理解其它金屬-空氣電池中的四電子反應(yīng)機(jī)理提供了新的見解。
03、關(guān)鍵創(chuàng)新
將實(shí)驗(yàn)表征和從頭計算方法相結(jié)合,闡明了鋰空電池中LiOH的四電子還原形成機(jī)理;解決了高活性O(shè)H*是否存在的爭論,解釋了高電壓平臺的形成原因。
04、核心內(nèi)容解讀
1、正極催化劑結(jié)構(gòu)表征
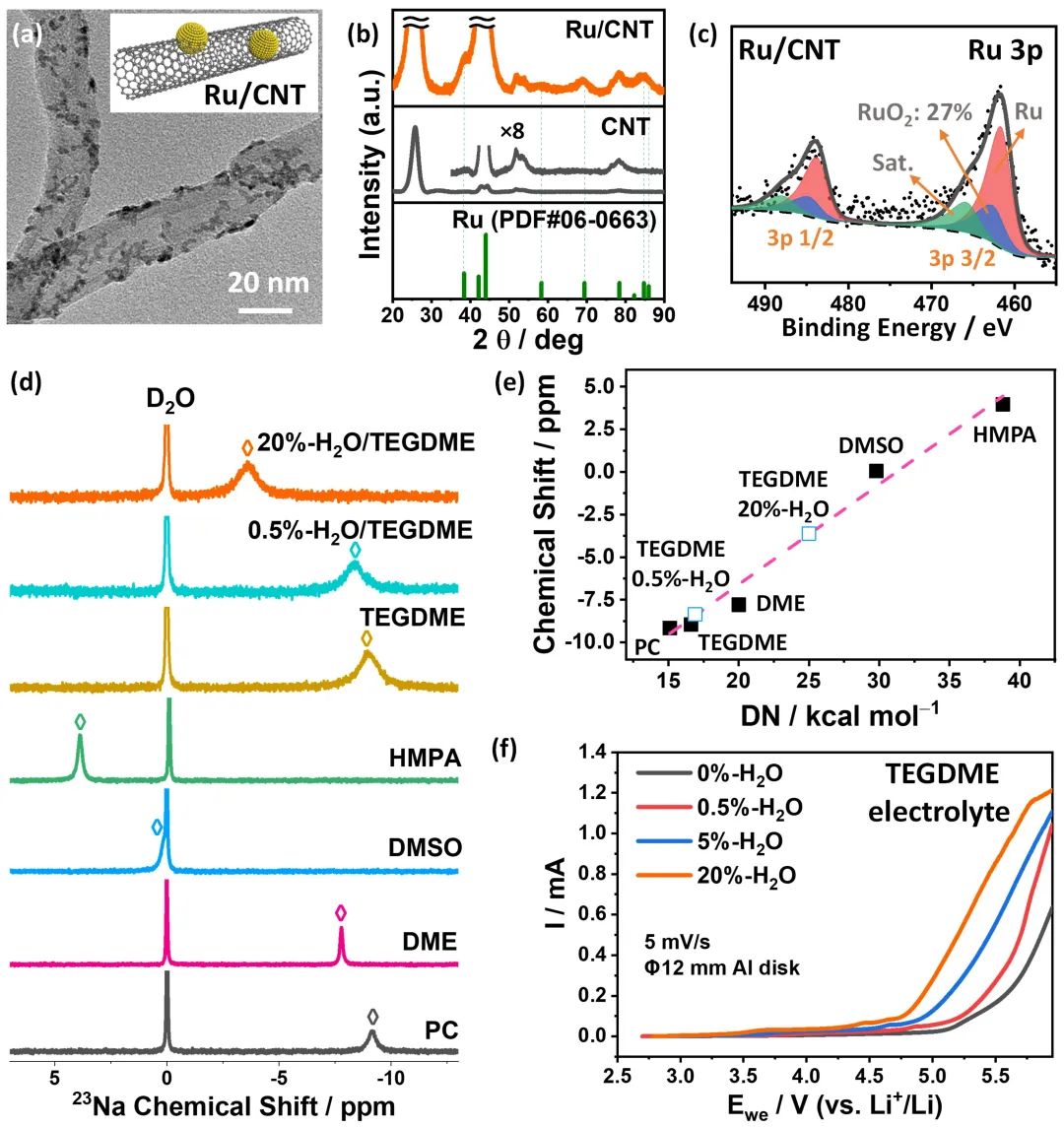
圖1. Ru/CNT催化劑及TEGDME基電解液的表征。(a-c)Ru/CNT催化劑的TEM、XRD和XPS結(jié)果;(d)各種電解質(zhì)溶劑的23Na核磁共振譜圖;(e)各種電解質(zhì)溶劑的核磁共振化學(xué)位移與給電子數(shù)(DN)的線性關(guān)系;(f)不同含水率的TEGDME基電解液的陽極LSV曲線。@Wiley
鑒于Ru基材料在析氧反應(yīng)(OER)中良好的活性,研究者以Ru/CNT催化劑作為正極材料,通過TEM、EDS和XRD對其結(jié)構(gòu)進(jìn)行了表征,發(fā)現(xiàn)Ru以3-5 nm的顆粒形式均勻分散在CNT上(圖1a-b)。
以水為氫氧化鋰形成的質(zhì)子源,制備了含水率在0-20wt%的H2O/TEGDME混合電解液溶劑,水還可以影響電解液的溶解能力,給電子數(shù)DN越高,對放電中間產(chǎn)物的溶解能力越強(qiáng)。研究者用23Na核磁共振分析了溶劑的DN數(shù),發(fā)現(xiàn)加入20wt%的H2O后,TEGDME的DN從最初的16.6增加到25.0kcal·mol-1(圖1d-e)。
線性掃描伏安法(LSV)用于評價了混合電解液的電化學(xué)穩(wěn)定性,結(jié)果表明,當(dāng)水分含量從0增加到20wt%時,電解液電化學(xué)穩(wěn)定窗口從0.82-5.1縮短到了1.88-4.75V(圖1f)。也就是說,加水提高了溶劑的溶解能力,但降低了其電化學(xué)穩(wěn)定窗口。
2、LiO2中間產(chǎn)物演變機(jī)理的分子動力學(xué)模擬
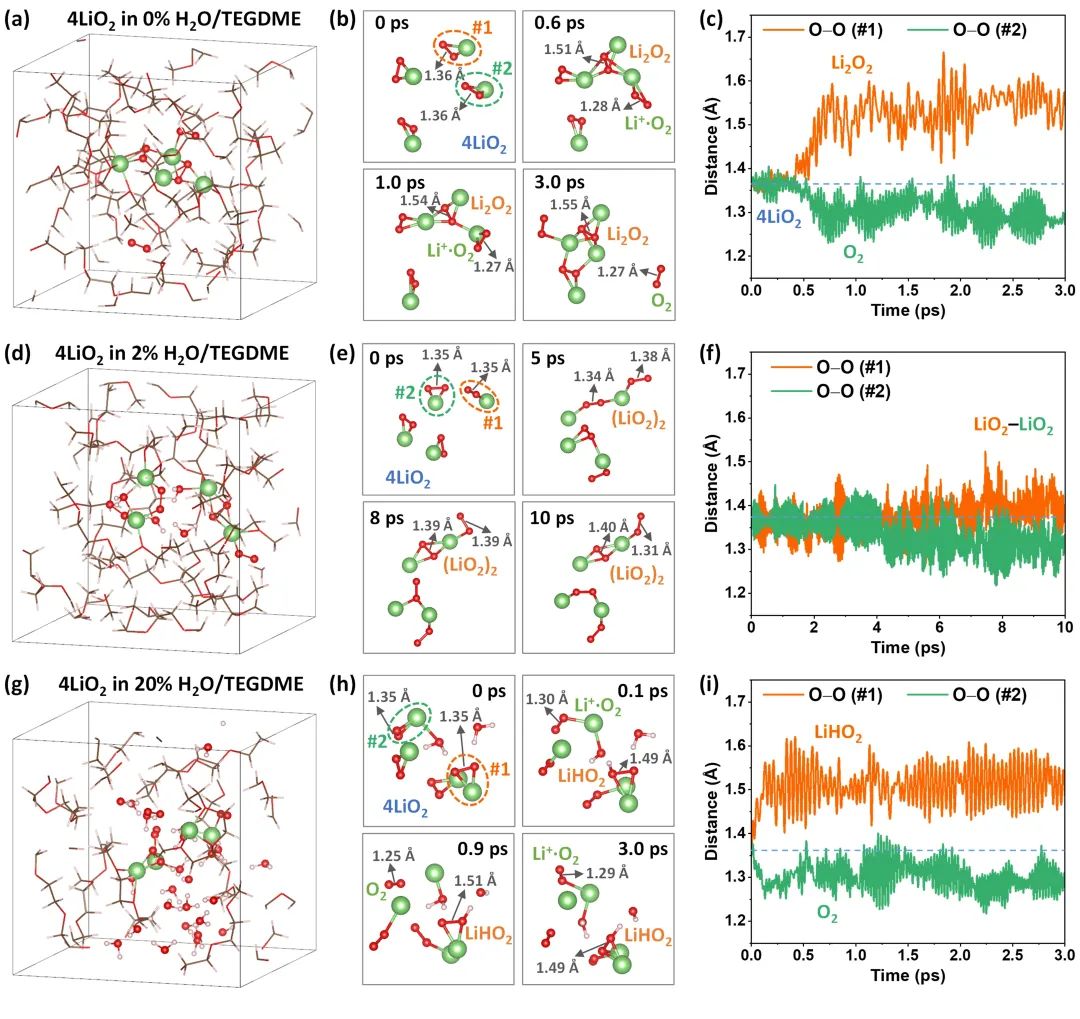
圖2. TEGDME基電解液中LiO2中間產(chǎn)物的AIMD模擬。(a,d,g)分別是3.0 ps時0%、2%和20%-H2O/TEGDME體系中LiO2的快照;(b,e,h)從AIMD模擬軌跡中提取的不同含水率的TEGDME基電解液中LiO2隨時間演化的結(jié)構(gòu)快照;(c,f,i)原始LiO2分子中O-O對的距離曲線。@Wiley
在鋰空電池中,LiO2是一種重要的中間產(chǎn)物,但其形成機(jī)理尚不明確。研究者利用從頭計算分子動力學(xué)模擬(AIMD),在300K下,以0.5fs為時間步長,對0%、2%和20%水含量的TEGDME基電解液中LiO2的形成機(jī)理進(jìn)行了研究。
結(jié)果表明,在0wt%H2O/TEGDME電解液中,LiO2在約0.5ps后發(fā)生歧化反應(yīng)生成了Li2O2和O2(圖2a-b),原始LiO2分子的O-O對距離曲線(圖2c)表明,其中一個O-O對距離突然從1.36?(LiO2)增加到了約1.55?(Li2O2),而另一個O-O對距離突然從1.36?(LiO2)減少到了約1.27?(O2),進(jìn)一步證明了LiO2發(fā)生了歧化反應(yīng)。但是,在無水電解液中LiO2的歧化反應(yīng)是比較緩慢的,也沒有觀察到LiO2的直接水解。
在20 wt% H2O/TEGDME電解液中,LiO2在約0.1 ps后就直接水解成LiHO2和O2(圖2g,h),原始LiO2分子的O-O對距離曲線(圖2i)表明,一個O-O鍵突然從1.35?(LiO2)增加到了約1.49?(LiHO2),而另一個O-O對突然從1.35?(LiO2)減少到了約1.29?(O2),證實(shí)了上述過程。他們還發(fā)現(xiàn),即使在10 ps的模擬時間內(nèi),也沒有觀察到LiHO2進(jìn)一步水解為H2O2。
根據(jù)上述AIMD模擬結(jié)果,研究者提出了LiO2中間產(chǎn)物的演變機(jī)理:在無水或者低含水率電解液中,LiO2首先歧化生成Li2O2和O2,然后在催化劑的幫助下,Li2O2水解成LiOH;在高含水量電解液中,LiO2首先水解成LiHO2,然后進(jìn)一步歧化成LiOH和O2。
3、LiOH反應(yīng)的不可逆性
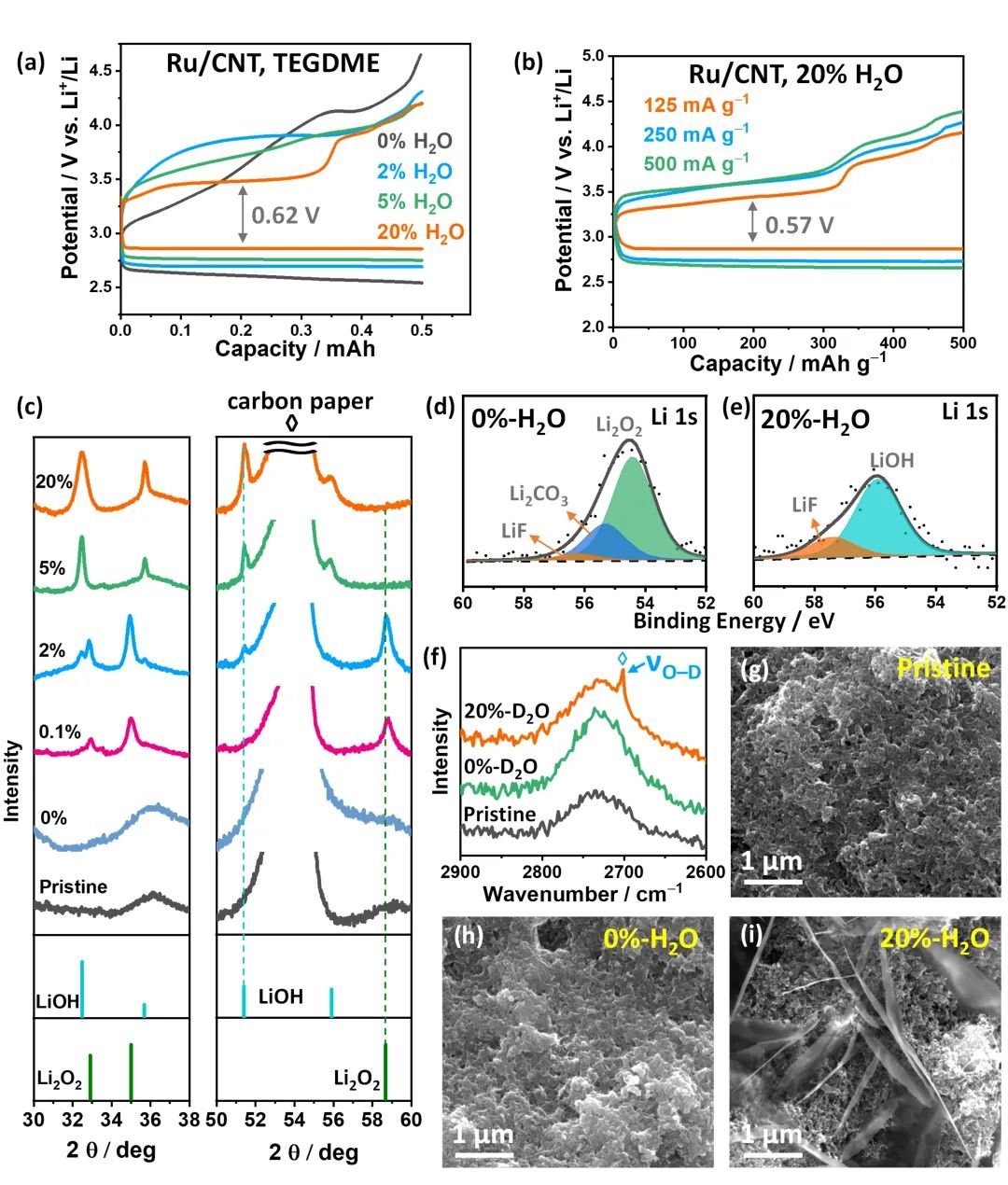
圖3. TEGDME基電解液中放電產(chǎn)物的非原位表征。(a)Ru/CNT在0-20%H2O/TEGDME電解液中的電壓曲線;(b)在125、250和500 mA·g-1的電流密度下20%-H2O/TEGDME電解液中Ru/CNT的倍率性能;(d-e)放電時Ru/CNT在無水和20%水的電解液中的XRD譜圖;(f)對應(yīng)的拉曼譜圖;(g-i)原始和放電后的Ru/CNT在無水和20%水電解液中的SEM圖像。@Wiley
研究者以氧正極、LiFePO4參比電極組裝了鋰空電池,以H2O/TEGDME/雙(三氟甲烷)磺酰亞胺鋰鹽(LiTFSI)為電解液,研究了其電化學(xué)性能。在20%H2O/TEGDME電解液中,Ru/CNT的充放電壓差最低為0.62 V(圖3a)。利用XRD和XPS,他們發(fā)現(xiàn)當(dāng)電解液中水含量從0增加到20%時,放電產(chǎn)物最初為無定形的Li2O2,然后是Li2O2/LiOH混合物,最后為LiOH,說明水是LiOH形成所必需(圖3c-e)。當(dāng)用D2O取代H2O時,拉曼光譜顯示在20%-D2O/TEGDME電解液中,在Ru/CNT上形成了LiOD,進(jìn)一步證實(shí)了水是氫氧化鋰的質(zhì)子源(圖3f)。在無水電解液中,放電產(chǎn)物形貌與20%-H2O/TEGDME中的不同,在有水狀態(tài)下形成了微米尺寸的片狀結(jié)構(gòu)(圖3h-i)。
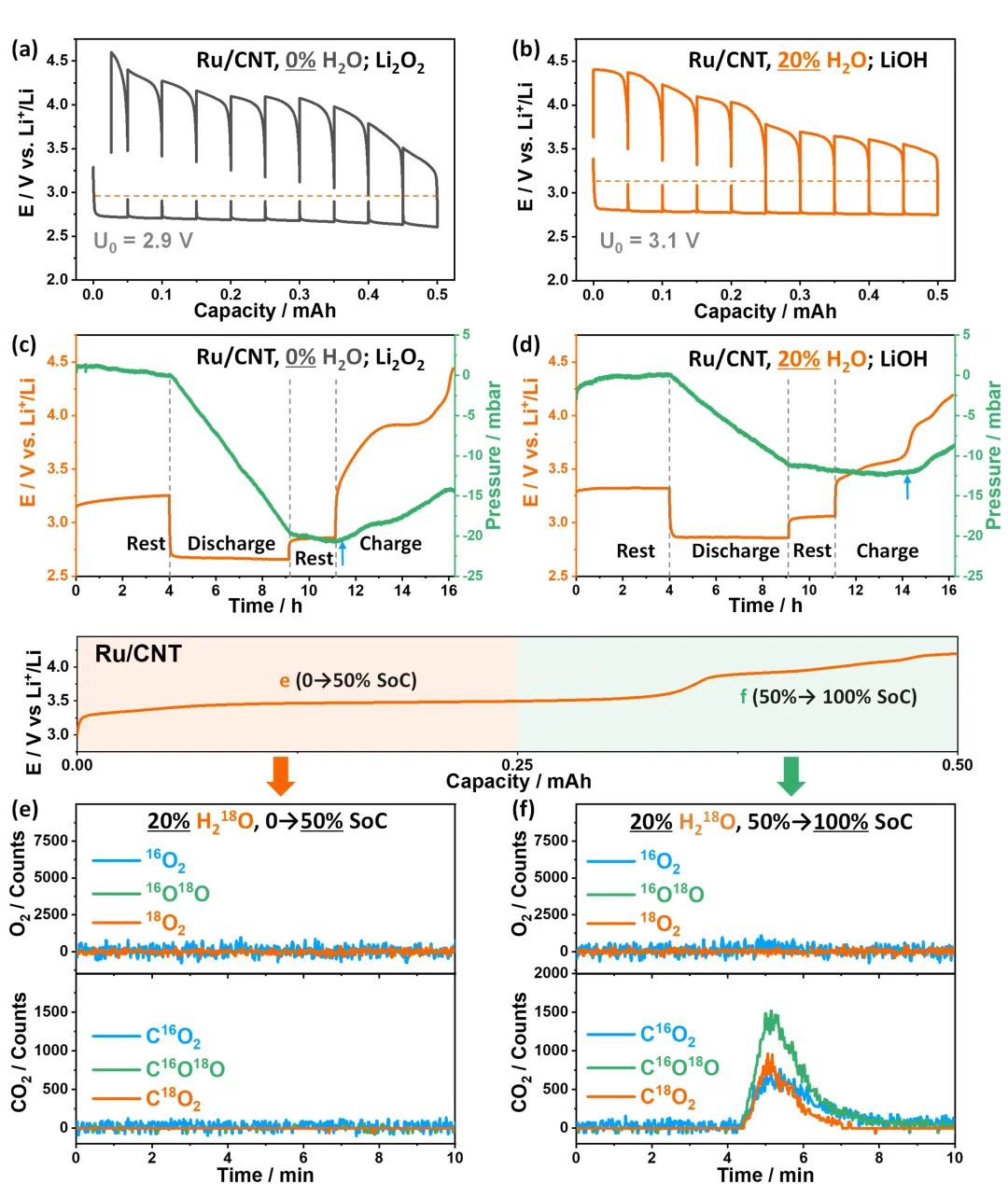
圖4.用GITT、OPERANDO氣體壓力測量和同位素標(biāo)記質(zhì)譜比較Li2O和LiOH化學(xué)反應(yīng)性。(a-b)Ru/CNT在0%和20%H2O/TEGDME電解液中的GITT結(jié)果;(c-d)相應(yīng)的OPERANDO氣體壓力測量結(jié)果;(e-f)相應(yīng)的同位素標(biāo)記的質(zhì)譜。@Wiley
研究者用GITT、OPERANDO氣體壓力測量和同位素標(biāo)記質(zhì)譜研究了LiOH的反應(yīng)性。
在GITT曲線中,0%-H2O/TEGDME電解液中,開路電位(OCP)在整個放電過程中保持在~2.9V,由于不溶性副產(chǎn)物在正極上的積累,OCP持續(xù)增加;在20%-H2O/TEGDME電解液中,OCP保持在~3.05V,在第一平臺上幾乎保持不變,遠(yuǎn)低于3.32 V的E0(O2/LiOH)標(biāo)準(zhǔn)電位(圖4a-b)。
理論上,Li2O2是通過2e?/O2過程形成,而LiOH是通過4e?/O2過程形成,這表明生成LiOH消耗的氧氣量是Li2O2的一半。當(dāng)電池放電到0.25 mAh后,在20%和0%-H2O/TEGDME電解液中,電池壓力分別下降到11mbar和20mbar,對應(yīng)于LiOH和Li2O2的形成,這表明LiOH的形成是一個4e?/O2過程(圖4c-d)。研究者還進(jìn)一步研究了充電時放出氣體的組成,發(fā)現(xiàn)Li2O2充電時產(chǎn)生了O2和CO2;LiOH在充電的前半程O2和CO2的析出要少得多,在后半程,只觀察到CO2的析出,
OPERANDO壓力測量和原位同位素標(biāo)記質(zhì)譜結(jié)果表明,在TEGDME基電解液中,由于充電時沒有O2析出,LiOH反應(yīng)性是不可逆的,這是因?yàn)樾纬闪烁呋钚缘腛H*物種,如果使用更穩(wěn)定的電解液,不會生成OH*的話,LiOH的轉(zhuǎn)化有可能變成可逆。
4、形成了酸性物質(zhì)
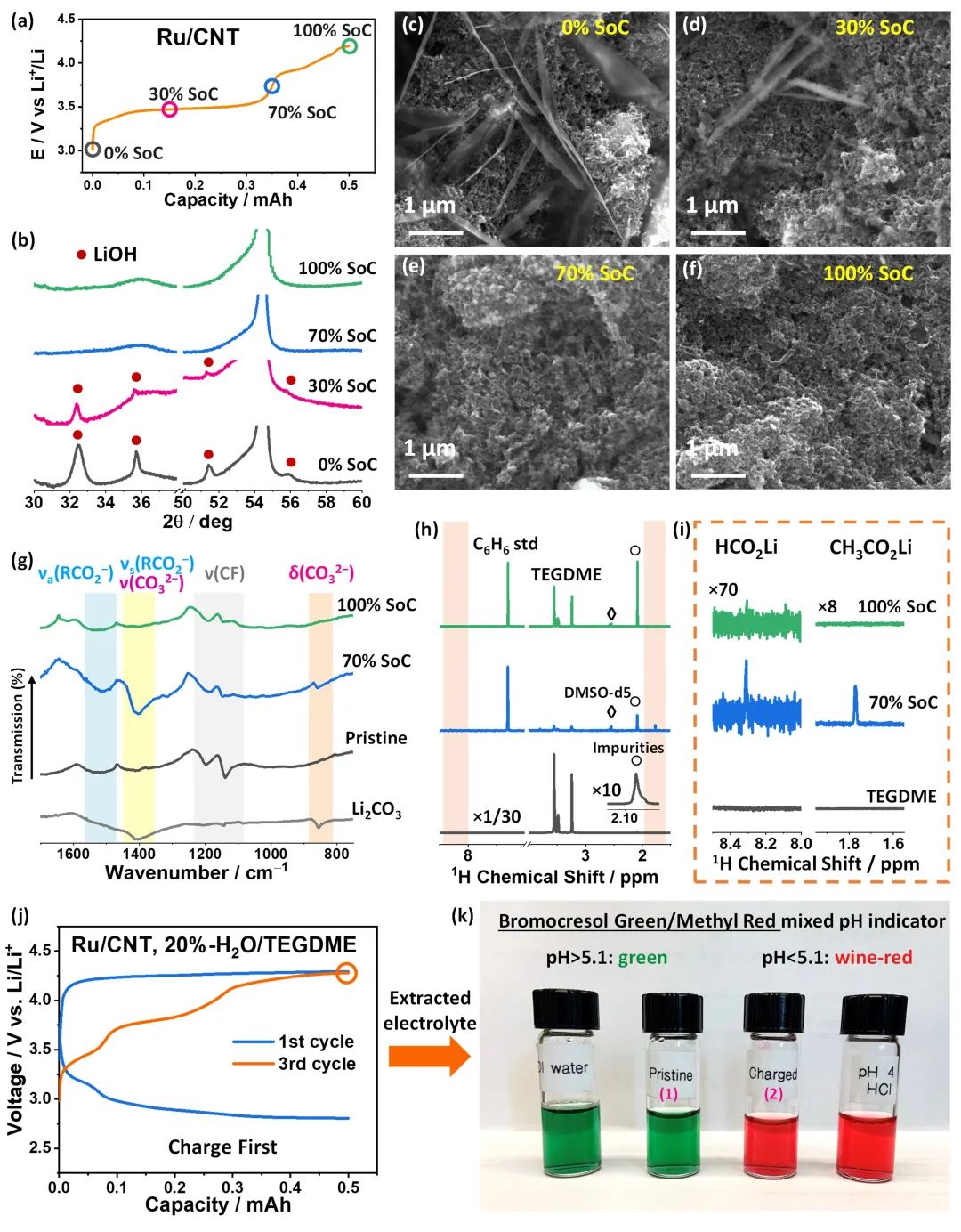
圖5.不同電荷狀態(tài)下TEGDME基電解液中充電產(chǎn)物的非原位表征。(a)在20%-H2O/TEGDME電解液中,Ru/CNT在0%、30%、70%和100%電荷狀態(tài)(SoC)下的電壓曲線;(b)相應(yīng)的XRD譜圖;(c-f)相應(yīng)的SEM圖像;(g)負(fù)載Li2CO3和各種Ru/CNT電極的紅外譜圖;(h-i)在70%和100%SoC下,TEGDME和Ru/CNT的D2O萃取物的1H核磁共振和變焦光譜圖;(j) 先充電后放電的Ru/CNT在20%-H2O/TEGDME電解液中的電壓曲線;(k)加入pH指示劑后,不同溶液的照片。@Wiley
研究者采用SEM、XRD、FTIR和核磁共振技術(shù)研究了LiOH的充電過程。發(fā)現(xiàn)在30%的SoC條件下,生成的LiOH被部分去除,在70%SoC時(即第一充電平臺結(jié)束時)被完全去除(圖5b,d,e),這是由于LiOH與電解液降解產(chǎn)生的酸性產(chǎn)物發(fā)生了化學(xué)反應(yīng),而酸性物質(zhì)是高活性O(shè)H*與電解液反應(yīng)生成的。FTIR和核磁共振結(jié)果表明,在70%的SoC下,正極上有不溶性的副產(chǎn)物沉積,包括Li2CO3、HCO2Li和CH3CO2Li,考慮到體系中不含有乙基官能團(tuán),他們認(rèn)為和CH3CO2Li可能是由OH*引發(fā)的一系列自由基鏈反應(yīng)形成的(圖5g,h)。
為了證實(shí)電解液降解形成了酸性物質(zhì),研究者分析了第三個循環(huán)周期電解液的pH值。結(jié)果表明,當(dāng)使用溴甲酚綠/甲基紅混合pH指示劑時,電解液確實(shí)是酸性,pH<5.1(圖5k)。
5、LiOH的反應(yīng)機(jī)理
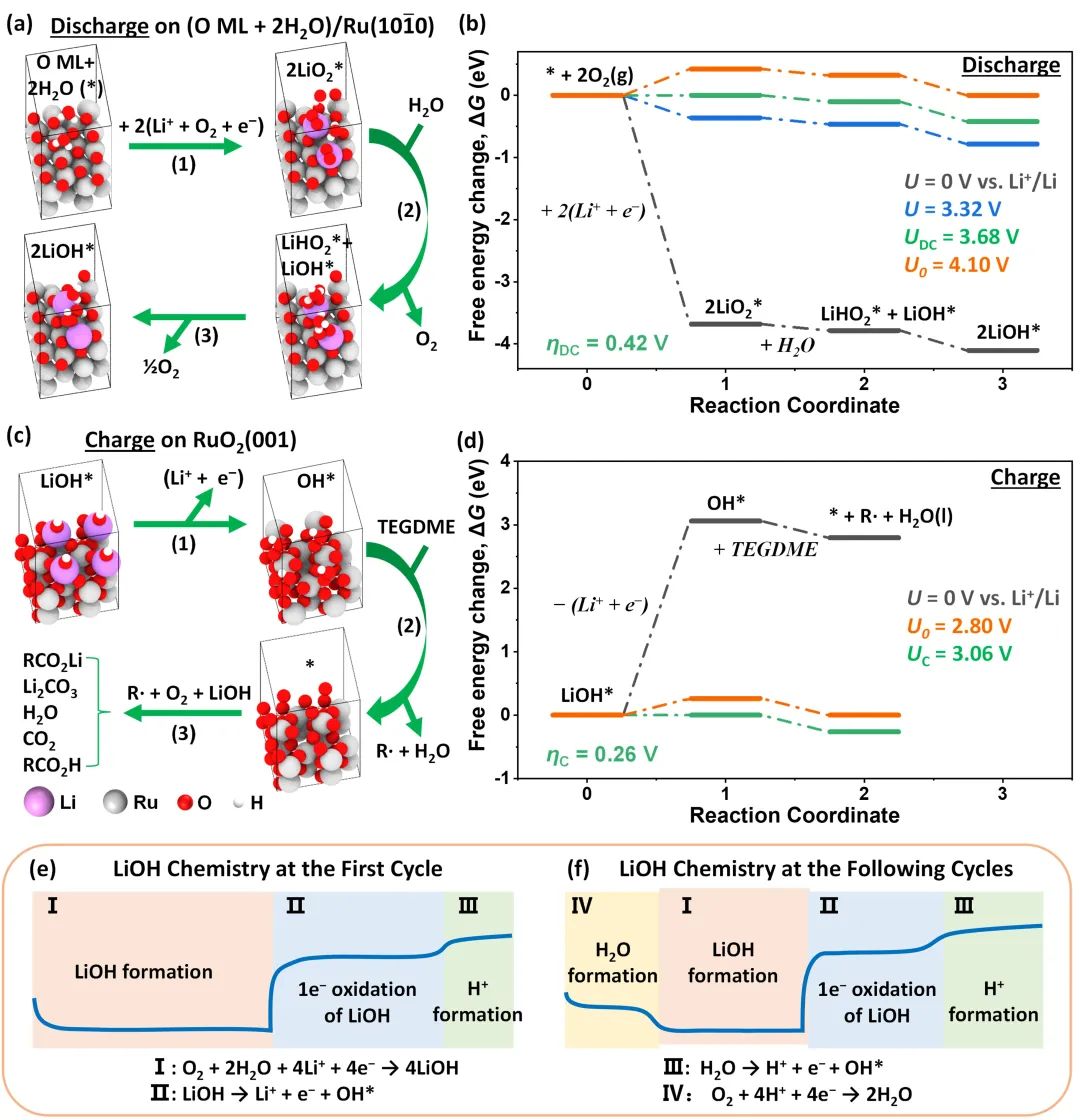
圖6. LiOH的反應(yīng)機(jī)理。(a,c)在高含水量電解液中Ru/CNT催化LiOH的反應(yīng)路徑和結(jié)構(gòu)模型;(b,d)用密度泛函理論計算放電和充電反應(yīng)在不同電勢下的能量圖;(e,f)在首次和隨后的循環(huán)中,LiOH在高水含量電解液中的反應(yīng)機(jī)理。@Wiley
研究者采用密度泛函理論計算了高含水量電解液中LiOH生成的反應(yīng)路徑和相應(yīng)的能量圖(圖6a-b)。結(jié)果表明,在放電過程中,O2首先通過單電子還原為LiO2*,然后LiO2*水解為LiHO2*,最后LiHO2*通過歧化反應(yīng)生成LiOH*,這一反應(yīng)路徑與AIMD模擬一致。在低水分含量的電解液中,O2還原后,LiO2*通過歧化反應(yīng)生成了Li2O2*,隨后進(jìn)一步水解形成LiOH*(圖6d-f)。
隨后,他們又計算了LiOH分解的反應(yīng)路徑和相應(yīng)的能量圖(圖6e-f)。在充電過程中,LiOH*首先通過單電子氧化形成*OH(圖6c),然后OH*從TEGDME中提取H原子,導(dǎo)致電解液降解(圖6c-d),同時生成了酸性產(chǎn)物,中和了LiOH,形成了Li2CO3和RO2Li等副產(chǎn)物。LiOH去除后,出現(xiàn)第二充電平臺,這與水的單電子氧化反應(yīng)有關(guān),生成了CO2和可溶酸RO2H。
在接下來的循環(huán)中(圖6f),放電過程顯示出兩個平臺。由于之前充電過程中質(zhì)子的積累,被還原的O2與質(zhì)子耦合形成了水,形成新的高電位放電平臺。
05、成果啟示
該工作結(jié)合實(shí)驗(yàn)和從頭計算方法,全面闡述了鋰空電池中LiOH復(fù)雜的演變機(jī)理。發(fā)現(xiàn)在Ru催化作用下,LiOH通過四電子還原反應(yīng)生成。在充電過程中,LiOH通過單電子氧化反應(yīng)分解,形成高反應(yīng)性的OH*,導(dǎo)致電解液分解形成酸性物質(zhì),隨后酸性產(chǎn)物中和了LiOH。隨著酸性質(zhì)子的不斷累積,形成了質(zhì)子耦合水,出現(xiàn)了一個新的高電壓平臺。
作者指出,利用氧化還原調(diào)控劑替代四電子還原反應(yīng),或者采用穩(wěn)定的固體電解質(zhì)或熔鹽電解質(zhì)來抑制OH*的生成,值得做進(jìn)一步研究。
審核編輯:郭婷
-
鋰離子電池
+關(guān)注
關(guān)注
85文章
3254瀏覽量
77924 -
電池
+關(guān)注
關(guān)注
84文章
10675瀏覽量
131296
原文標(biāo)題:Angew:揭秘鋰空電池LiOH正極化學(xué)演變的前世今生
文章出處:【微信號:清新電源,微信公眾號:清新電源】歡迎添加關(guān)注!文章轉(zhuǎn)載請注明出處。
發(fā)布評論請先 登錄
相關(guān)推薦
新技術(shù):鋰空氣電池是否能成為下一代電池技術(shù)標(biāo)準(zhǔn)?
鋰空氣電池的研究進(jìn)展和最新情況
鋰錳電池有什么優(yōu)點(diǎn)?
鋰離子電池充放電機(jī)理及“鋰亞原子”模型
鋰離子電池充放電機(jī)理的探索及“鋰亞原子”模型的建立
鋰硫電池電化學(xué)循環(huán)過程及其正極反應(yīng)機(jī)理的研究進(jìn)展介紹





 鋰空電池放電過程中LiOH的形成機(jī)理研究
鋰空電池放電過程中LiOH的形成機(jī)理研究










評論