細胞外囊泡(EVs)由不同類型細胞產生,對細胞間交流至關重要。不同細胞來源的EV亞群可以準確地與各自對應受體細胞精確相互作用,進行內化并發揮功能。因此,分離多個EVs亞群對于充分解析EVs生物功能具有重要意義。 目前已經開發了多種EVs分離技術,包括超速離心、尺寸排阻和親和分離等。其中,親和分離通常具有較好選擇性,其原理為主要通過抗體/核酸適體等識別分子對EVs上單一生物標志物的相互作用以實現EVs分離。然而,盡管在某些應用中親和分離行之有效,但由于大多數EVs亞群缺乏特異性單一生物標志物,所以較難實現它們與密切相關的EVs混合群體的明確區分。
基于適體識別的DNA計算技術的快速發展為EVs分離分析離提供了一種強有力的工具。宋彥齡教授團隊前期已發展了基于雙適體鄰位連接的特定EV亞群的高靈敏檢測方法(Angew. Chem. Int. Ed. 2021, 60, 7582),以及基于適體靶向識別和代謝標記的EV特定蛋白糖基化成像方法(Angew. Chem. Int. Ed. 2021, 60, 18111)。然而,考慮到邏輯計算設計的復雜性以及EVs的高度異質性,現有的方法往往一次只能定量一個特定的EVs亞群,難以同時分離多個EVs亞群。由于分離方法的缺乏,目前難以實現對多個EVs亞群同時分離分析及下游分析,從而阻礙了對EVs亞群生物學功能和臨床應用的深入探索。因此,亟需發展一種多EVs亞群的分離策略。

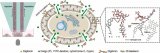
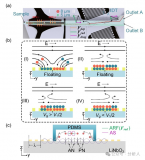
近日,廈門大學宋彥齡教授團隊在國際期刊small methods上發表了題為“Isolation of PD-L1 Extracellular Vesicle Subpopulations Using DNA Computation Mediated Microfluidic Tandem Separation”的研究論文,開發了一個模塊化的串聯微流控分離平臺(如圖1所示),能夠將多個結合事件作為輸入,進行邏輯計算,并產生兩個獨立的輸出,用于串聯微流控芯片的EVs亞群分離。該平臺利用雙適體識別的優異選擇性和串聯芯片的靈活性,實現了腫瘤PD-L1 EVs和非腫瘤PD-L1 EVs的順序分離。因此,所開發的平臺不僅能有效區分癌癥患者和健康志愿者,還能為評估免疫異質性提供新的線索。此外,捕獲的EVs可以通過DNA水解反應高效釋放,與下游的質譜分析兼容,進行EV蛋白質組分析。總的來說,這一策略有望分離出不同的EVs亞群,將EVs轉化為可靠的臨床生物標志物,并準確研究不同EVs亞群的生物學功能。文章通訊作者為廈門大學宋彥齡教授,第一作者為廈門大學碩士研究生盧銀珠與林冰倩博士。
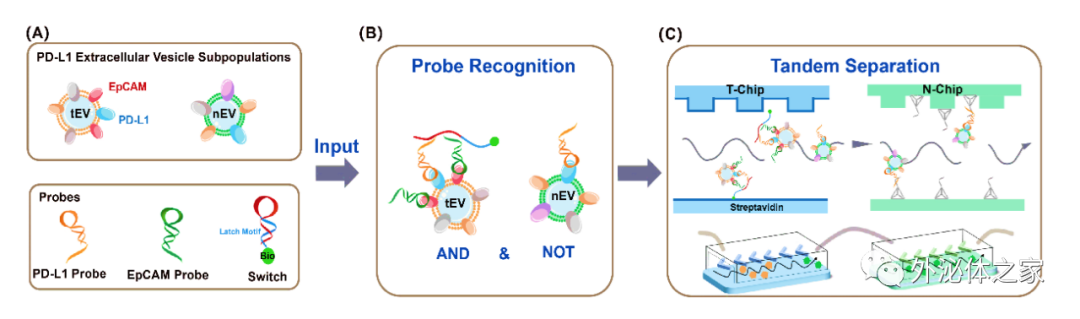
圖1 DNA計算介導的微流控串聯實現PD-L1細胞外囊泡亞群分離的原理
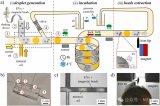
該論文將肺癌患者和健康志愿者的血漿樣本用來研究所開發策略的臨床效用。將血漿樣本與親和探針和開關探針孵育后通入到串聯芯片中。如圖2A所示,對于T-Chip,癌癥患者捕獲的EVs數量遠遠高于健康志愿者(t檢驗:P = 0.0006)。而對于N-Chip,除了一些健康志愿者的數值較高外,兩類樣品的區別并不明顯(圖2B,t檢驗:P = 0.02)。值得注意的是,對于N-Chip分離的PD-L1 EVs亞群,由于腫瘤患者中正常細胞產生的PD-L1 EVs可能因免疫逃逸而被分泌抑制,所以患者捕獲的EVs的平均量低于健康人。如果只是將同一樣本的兩種芯片信號簡單相加,而非順序分離,癌癥患者和健康志愿者的區別會被削弱(圖2C和2D,t檢驗:P = 0.04,ROC曲線的AUC值為:T-Chip為0.9664,T-Chip + N-Chip為0.7731),這可能是因為免疫異質性導致正常細胞分泌的PD-L1 EVs數量差異較大造成。這些結果表明,該策略不僅可以通過腫瘤PD-L1 EVs區分癌癥和正常人,同時可以獲得正常細胞來源的PD-L1 EV亞群的數量,以協助免疫異質性評估。
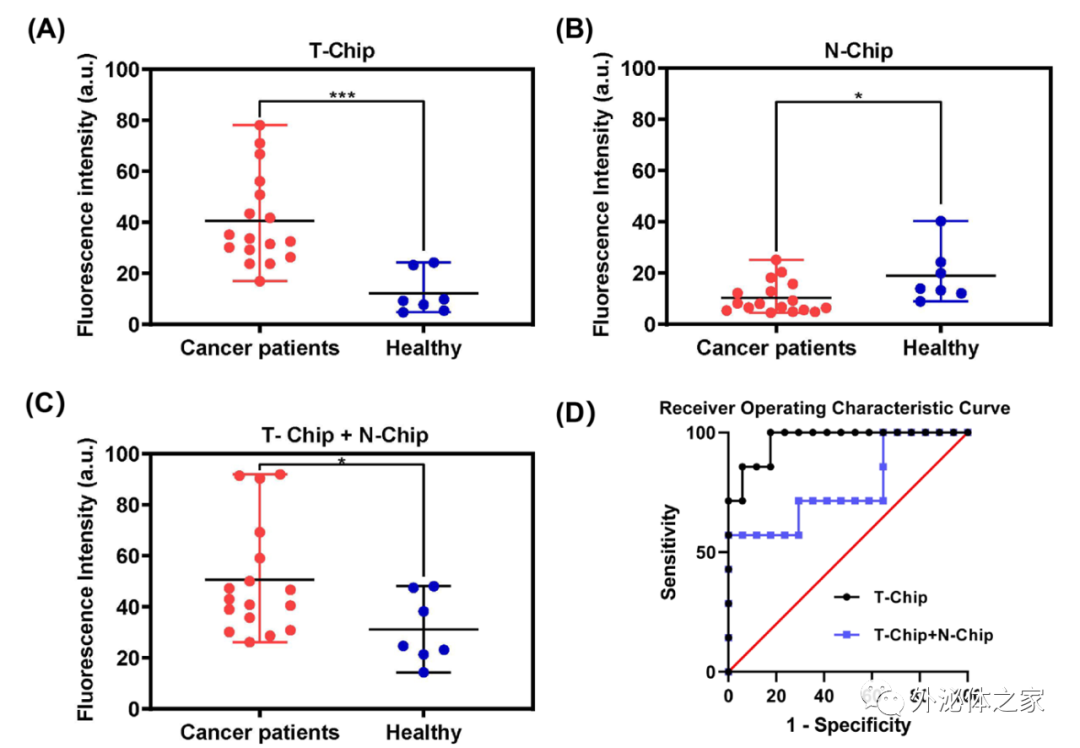
圖2 臨床樣本中腫瘤來源和非腫瘤細胞來源PD-L1 EVs定量
總體而言,所開發的平臺通過EVs亞群的同時分離,有望能讓人們更好地理解EVs的生物學功能、以及對癌癥進展、免疫反應以及對免疫治療耐藥性的實時評估。
論文鏈接:
https://doi.org/10.1002/smtd.202300516
-
DNA
+關注
關注
0文章
243瀏覽量
31136 -
微流控
+關注
關注
16文章
542瀏覽量
18976
原文標題:利用DNA計算介導的串聯微流控平臺,實現細胞外囊泡亞群的有效分離
文章出處:【微信號:Micro-Fluidics,微信公眾號:微流控】歡迎添加關注!文章轉載請注明出處。
發布評論請先 登錄
相關推薦
微流控芯片在細胞培養檢測中的應用
功率放大器應用分享:利用微流控技術促進干細胞心肌組織成熟
S型微流控芯片的優勢
ATG-2000系列功率信號源在介電電泳細胞分選測試中的應用

ATA-7020高壓放大器在微流控3D細胞微球培養中的應用
武漢大學:研究微流控電化學集成傳感器,快速、高效分離和靈敏檢測致病菌
淺談微流控芯片技術





 利用DNA計算介導的串聯微流控平臺,實現細胞外囊泡亞群的有效分離
利用DNA計算介導的串聯微流控平臺,實現細胞外囊泡亞群的有效分離










評論